Изотермический процесс
Для изотермического процесса характерен определенный процесс, который происходит с газовым веществом, который в свою очередь имеет неизменную массу и постоянную неизменяемую температуру вещества.
Изотермический процесс для температуры газа, основные формулы и величины
Изотермический процесс характеризует состояние газа и данное состояние записывается следующими формулами:
\[p_{1} V_{1}=v R T\]
\[p_{2} V_{2}=v R T\]
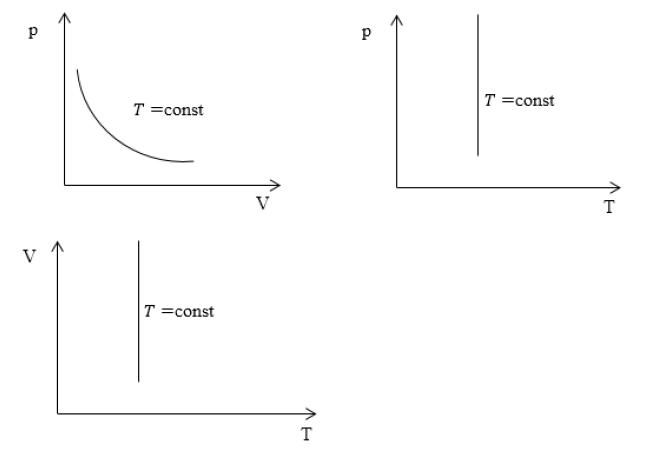
Изотермический процесс для системы координат
Характерные изотермические процессы зачастую отражают на термодинамических графиках и диаграммах.
Если рассмотреть подробно график можно увидеть линию, именно ее и принято называть изотермой. Она непосредственно является основной характеристикой процесса.
Изотермический процесс — закон Бойля-Мариотта
Разделим уравнение для второго состояния газа на выражение первого состояния и получим основное уравнение изотермического процесса.
\[\frac{p_{2} V_{2}}{p_{1} V_{1}}=1\] или \[p V=\mathrm{const}\] (постоянное значение)
Полученное уравнение и будет называться законом Бойля-Мариотта.
Данный процесс осуществляется с использованием тепловой энергии.
В случае, когда объем увеличивается, или отводится, для его уменьшения.
Составим первое значение термодинамики.
Затем постепенно получим уравнение для определения работы.
А также вычисления внутренней энергии и количества теплоты тела при изотермическом процессе.
Температура является неизменной, поэтому, изменение значения внутренней энергии будет равняться нулевому значению. \[(d \cup=0)\].
Из этого следует, что для изотермического процесса все подводимое тепло направлено на работу, которую совершает газ:
где:
- \[\delta Q\] — тепло элементарного характера, которое подводится ко всей системе;
- dA — работа элементарного типа, совершаемая газом в изотермическом процессе;
- i — количество свободных степеней газовых молекул;
- R — газовое значение постоянной;
- d — значение молей для газа;
- V1— первоначальное значение объема газа;
- V2— окончательное значение объема газа.
Давление газа, которое зависит от уравнения газа в идеальном состоянии.
Подставим вышеуказанное выражение в подынтегральное выражение:
Составленное уравнение необходимо определения значения работы, которую совершает газ в изотермическом процессе.

Нет времени решать самому?
Наши эксперты помогут!
Контрольная
| от 300 ₽ |
Реферат
| от 500 ₽ |
Курсовая
| от 1 000 ₽ |
Как найти изотермический процесс — примеры решения задач
Пример №1
Основное содержание задания: газ идеального состояния, имеет способность расширяется, имея постоянную температуру, от объема.
Известно сила давления во втором состоянии и оно равняется \[p_{2}=1 \cdot 10^{5} \mathrm{\Pi a}\].
Определить:
- Величину изменения внутренней энергии газа;
- Значение работы, которую совершает газовое вещество в данном процессе;
- Какое необходимое количество теплоты получает газ в процессе работы.
Методика решения:
Внутренняя энергия газа неизменна, так как процесс который рассматривается в задаче, является изотермическим:
Из основного закона термодинамики можно определить:
Составим и запишем уравнение, которое отражает окончательное (конечное) состояние газа:
Подставим в уравнение для температуры вышеизложенные формулы и получим решение:
Следовательно, все величины расположены в международной системе единиц (СИ), можно провести вычисления и определить неизвестные значения:
Ответ задачи:
- значение изменения внутренней энергии газа в рассматриваемой процессе равно нулевому значению.
- работа, которая совершается в процессе газовым веществом равняется \[6,6 \cdot 10^{4} \text { Дж }\].
- Необходимое количество тепловой энергии равно: \[6,6 \cdot 10^{4} \text { Дж }\].
Пример №2
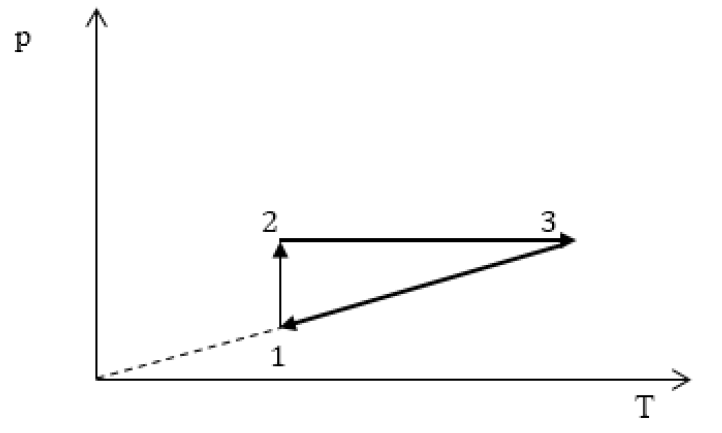
Задание: изображен график, где изменяется идеальное состояние массы газа равное m в координатных осях p (V).
Нужно перенесите данный процесс на координатные оси в p(T).
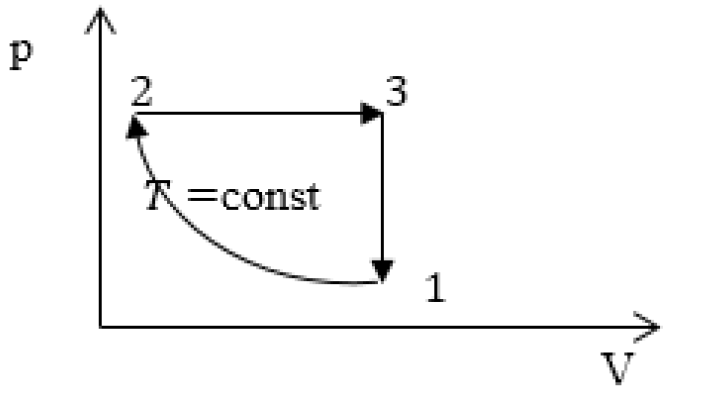
На данном графике изображен круговой процесс.
Где:
- Прямая 1-2 является изотермическим процессом с константой \[(T=\text { cons } t)\]. Следовательно значение объема будет уменьшается \[(\mathrm{V} \downarrow)\], а давления соответственно расти \[(p \uparrow)\].
- Прямая 2-3 отражает изобарический процесс \[(p=\text { const })\]
const). Для данного процесса характерно увеличение объема \[\mathrm{V} \uparrow\] и применяя закон Гей-Люссака, увеличение \[Т \uparrow\]
- Прямая (отрезок) 3-1 является изохорным процессом объем будет постоянной величиной \[(\mathrm{V}=\text { const })\], а \[p \downarrow\],а исходя из закона Шарля \[T \downarrow\].
Все перечисленные процессы изобразим на координатных осях p(T).